Celtic Holland®

Dinámica de la leptospirosis en los animales domésticos
M.C.V. Ramón Alfredo Delgado González
División Regional de Ciencia Animal
Universidad Autónoma Agraria Antonio Narro, Unidad Laguna
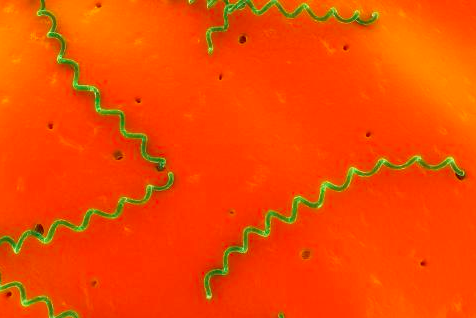
Historia. El primer reporte de leptospirosis se llevó a cabo en 1886 en Alemania por el Dr. Adolf Weil, quien reportó en humanos una enfermedad febril con ictericia asociada a un trastorno que afectaba los riñones, hígado y bazo. En 1887 una enfermedad similar fue descrita por Goldschmidt, quien la registró como “Síndrome de Weil”. La morfología de las leptospiras fue descrita en 1907 como un “organismos en espiral con extremos en forma de gancho” al cual nombraron Spirochaeta interrogans, sin embargo, el Dr. Hideyo Noguchi, en 1917, lo describió dentro de un nuevo género llamándolo “Leptospira”. En México los primeros casos de leptospirosis fueron reportados en 1920, en humanos, en Mérida, Yucatán. Sin embargo, no fue sino hasta la década de los 30´s que se empezaron a reportar casos en animales, siendo en 1953, el primer reporte de leptospirosis en bovinos en México.
Fundamentos. La leptospirosis es una enfermedad bacteriana zoonótica de distribución mundial, es endémica en climas tropicales y templados. Afecta a la mayoría de los animales domésticos, y se ha reportado en reptiles, aves, anfibios y artrópodos. Es considerada una enfermedad infecciosa emergente en humanos, y por lo tanto, de gran importancia en salud pública.
Las leptospiras pertenecen a la familia Leptospiraceae del phylum Spirochaete. Son delgadas espiroquetas móviles, con un extremo en forma de gancho, aeróbicas y de lento crecimiento que tienen un óptimo desarrollo a 30 °C. El organismo es sumamente sensible a los pH extremos, a la falta de humedad y a los desinfectantes suaves incluyendo al detergente. Existen especies saprófitas y patógenas en la naturaleza. Las especies saprófitas viven en el agua y suelo y no infectan a los animales.
Taxonomía. El género Leptospira incluye 19 especies genéticamente identificadas, y alrededor de 260 serovariedades patógenas, de acuerdo a los patrones de antígenos de superficie, y están combinadas en 24 serogrupos. No existe correlación entre las clasificaciones serológica y genética.
El género es bastante heterogéneo, se clasifica de acuerdo a sus características genéticas y se divide en tres grupos, como patógenas, no patógenas, y oportunistas posiblemente patógenas. Las leptospiras patógenas incluyen ocho genoespecies: Leptospira interrogans, Leptospira borgpetersenii, Leptospira kirschneri, Leptospira santarosai, Leptospira weilii, Leptospira alexanderi, Leptospira noguchii y Leptospira alstonii (Brenner y col., 1999). El grupo de especies saprófitas incluye seis microorganismos de vida libre que se encuentran en la superficie de aguas como Leptospira biflexa, Leptospira wolbachii, Leptospira kmetyi, Leptospira yanagawae, Leptospira terpstrae y Leptospira vanthielii. Otro grupo comprende especies de “comportamiento intermedio”, cuyo papel en su patogenicidad no ha sido demostrado: Leptospira inadai, Leptospira broomii, Leptospira fainei, Leptospira wolfii y Leptospira licerasiae.
Patogenia. Las fuentes de leptospiras son esencialmente mamíferos domésticos y silvestres que albergan las espiroquetas en los túbulos contorneados proximales de los riñones y eliminan intermitentemente las leptospiras en grandes números (106/mL) a través de la orina hacia el ambiente, alrededor del séptimo día post-infección. Por consiguiente, la orina de los animales infectados presenta una potencial fuente de infección.
La leptospirosis tiene un período de incubación de 3 a 20 días, variable según la virulencia y cantidad de microorganismos y el estado fisiológico e inmunológico del hospedador. Para sobrevivir en el ambiente, la bacteria necesita ser capaz de detectar y moverse hacia condiciones favorables y lejos de condiciones desfavorables. La quimiotaxis y motilidad permite a la bacteria penetrar las barreras de los tejidos del hospedador durante la infección, ésta se basa en un movimiento direccional hacia un atrayente o lejos de un repelente. La adaptación a diversos estímulos ambientales fuera y dentro del huésped y la habilidad para sobrevivir en el torrente sanguíneo contribuye para que las leptospiras puedan causar enfermedad, al migrar a través de los espacios intercelulares.
Las leptospiras entran al cuerpo a través de membranas mucosas de los ojos, nariz o garganta y a través de cortes o abrasiones de la piel, e invaden los tejidos y líquidos del hospedador. Después del contacto, las espiroquetas se diseminan por vía sanguínea y se mueven hacia la hemoglobina, movimiento que está relacionado con su virulencia, para multiplicarse en los órganos blanco tales como los riñones, hígado, pulmones y útero resultando en un amplio espectro de manifestaciones clínicas. La fase septicémica o leptospiremia, se caracteriza por la aparición de anticuerpos y leptospiras en sangre.
Las leptospiras penetran la piel erosionada y rápidamente establecen una infección sistémica al atravesar las barreras de los tejidos. Las leptospiras pueden moverse a través de la barrera de los tejidos por asociación con los vasos sanguíneos, ya que las leptospiras son detectadas agregadas alrededor de los capilares en la capa muscular, y se diseminan a través de las uniones intercelulares y también se pueden detectar en el citoplasma de las células endoteliales del hospedador.
Cuando penetran las leptospiras, se encuentran en sangre a las 2 horas post-infección (h.p.i.), las cuales van aumentando entre las 8 y 96 h.p.i. llegando a su pico y empiezan a disminuir a las 144 h.p.i. Las leptospiras son detectadas engolfadas por las células endoteliales vasculares, las cuales se hinchan, causando daño de la membrana basal vascular y frecuentemente agregadas alrededor de los capilares en la dermis y tejido subcutáneo bajo el sitio de infección. Se pueden encontrar hemorragias en la dermis alrededor del sitio de infección antes de la aparición de hemorragias en órganos internos. La capa de queratinocitos intactos es una barrera muy eficiente que puede prevenir la infiltración de leptospiras al hospedador. En las capas musculares, las leptospiras son detectadas agregadas alrededor de los capilares a las 24 h.p.i., las cuales son frecuentemente fagocitadas por neutrófilos y macrófagos. Después se diseminan al hígado, pulmones, riñones, útero, glándula mamaria y otros tejidos, de casi todos los animales dentro de las 96 h.p.i. En el hígado las leptospiras son encontradas en las membranas de los hepatocitos, también como un depósito granular en las células de Kupffer después de las 24 h.p.i. Los pulmones pueden mostrar leptospiras en los focos de hemorragias y rara vez alrededor o fuera de éstas. En los riñones, un gran número de leptospiras típicas son vistas en los espacios glomerulares (96 h.p.i.). Se pueden encontrar leptospiras alineadas rodeando los capilares peritoneales 72 h.p.i.
La adherencia a las células y a componentes de las matrices extracelulares (MEC) del huésped es probablemente un paso necesario para que las leptospiras penetren, se diseminen y persistan en los tejidos de los hospedadores mamíferos. Se han encontrado un amplio rango de moléculas de adhesión en las leptospiras que le dan la habilidad para migrar a través de los tejidos, muchas proteínas leptospirales tienen afinidad por las MEC y superficies de las células.
Los animales infectados con leptospiras, vía conjuntival y por heridas de piel, desarrollan signos clínicos y cambios patológicos similares. Las leptospiras patógenas son capaces de sobrevivir y ser más resistentes a la acción del sistema inmune.
Las leptospiras no son parásitos intracelulares pero pueden introducirse en las células residiendo en estas transitoriamente, en células no fagocíticas normales los microorganismos entran y se encuentran en fagosomas en el citoplasma. Al utilizar éste mecanismo de entrada a la célula, le permite a la Leptospira diseminarse a órganos blanco, evadiendo la respuesta inmunológica, el microorganismo parece sobrevivir a menos que estén presentes anticuerpos específicos.
Al llegar al hígado o riñones las cepas infecciosas de Leptospira se adhieren a componentes de las MEC entre los intersticios de los hepatocitos y las células epiteliales tubulares, tales como colágeno tipo I, tipo IV, laminina y fibronectina. Debido a que las células epiteliales de los túbulos proximales del riñón producen proteoglicanos, éstas pueden facilitar la colonización del riñón, especialmente en animales huéspedes.
Durante la leptospiremia, la migración de las leptospiras al útero y oviducto de animales no gestantes, y a la placenta en gestantes, producen congestión capilar, y células endoteliales vacuoladas y efectos de necrobiosos y apoptosis, además se observan leptospiras en las células endoteliales. Estos daños son capaces de producir muerte embrionaria temprana y aborto en todos los estadios de gestación y las leptospiras pueden encontrarse en riñones, adrenales e hígado de fetos abortados. La inflamación que pueda producirse a nivel de cotiledones trae como consecuencia retención de placenta, además de que puede causar infertilidad, e incluso esterilidad en casos extremos.
Signos y lesiones. Los signos clínicos de la leptospirosis están influenciados directamente por la virulencia de la serovariedad infectante, la dosis del inóculo, la edad, susceptibilidad y condición física de los animales. La infección aguda puede ser potencialmente letal o en hospedadores de mantenimiento puede causar una enfermedad crónica con escasa signología clínica; la mayoría de las infecciones resultan en ligera enfermedad con signos inespecíficos como fiebre y debilidad muscular. El cuadro clínico de una leptospirosis severa se caracteriza por disfunción hepática, renal y hemorragias. Ocasionalmente se puede observar orina con sangre, hemoglobinuria, decaimiento, anorexia y muerte en pocas horas. Los animales por lo general mueren de choque séptico con falla multiorgánica.
En la infección leptospiral los animales muertos pueden mostrar a la necropsia hepatomegalia, esplenomegalia, e ictericia en mucosas y tejido subcutáneo, y hemorragias petequiales diseminadas en casi todos los órganos y tejidos. En la forma severa hay alteraciones hemodinámicas e hipovolemia debido a deshidratación y al efecto directo de las toxinas que dañan el endotelio vascular e incrementan la permeabilidad. Varios factores están involucrados en el daño renal agudo en la leptospirosis, incluyendo acción nefrotóxica directa de las leptospiras, hiperbilirrubinemia, rabdomiolisis, e hipovolemia. Las anomalías en la función tubular preceden una disminución en la tasa de filtración glomerular, lo cual podría explicar la alta frecuencia de hipokalemia.
Las hemorragias se caracterizan por petequias y hematomas coalescentes, diseminadas en la piel, hasta el tejido subcutáneo y músculo que progresan con el tiempo. Posteriormente se pueden desarrollar hemorragias petequiales en pulmones. En el hígado se aprecian hemorragias, edema y focos de necrosis. Los riñones también muestran hemorragias extensivas en la superficie peritoneal. Además las células del epitelio tubular presentan necrosis e infiltración de eritrocitos en su luz, presentando hematuria después.
Epidemiología. Las leptospiras que causan enfermedad se pueden clasificar como 1) adaptadas al hospedador, las que infectan a los animales hospedadores de mantenimiento, 2) no adaptadas al hospedador, las que infectan a los animales hospedadores accidentales. Las diversas serovariedades se adaptan a diferentes hospedadores reservorios animales, silvestres o domésticos y el reconocimiento de estas serovariedades tiene importancia epidemiológica. Los animales pueden servir como reservorios de algunas serovariedades y convertirse en hospedador incidental de otras.
Muchas especies de animales, domésticos y silvestres, sirven como hospedadores reservorios (portadores), resultando en una diseminación global de la enfermedad, probablemente los reservorios silvestres sean los hospedadores de mantenimiento de la mayoría de las leptospiras patógenas. Los humanos son hospedadores incidentales. Los humanos y los animales pueden infectarse por contacto directo con líquidos corporales de animales que están eliminando las leptospiras por la orina, secreciones uterinas, y leche, por tejidos de animales infectados, después de la ingestión de agua y alimentos e inhalación de gotas en aerosol contaminadas por orina, o indirectamente a través de la exposición de suelos húmedos, aguas y vegetación. Las leptospiras patógenas pueden sobrevivir por periodos prolongados de tiempo en el ambiente.
Leptospirosis en bovinos. En el ganado bovino, la leptospirosis produce pérdidas económicas de manera primaria por sus efectos sobre la reproducción, pudiendo aparecer muerte embrionaria temprana, mortinatos, abortos, y/o nacimientos de animales débiles que pueden morir en los primeros días de vida e infertilidad. De manera secundaria, también puede haber pérdidas económicas como consecuencia del “síndrome de la caída de la leche” o agalactia transitoria.
Además, la leptospirosis puede cursar con diferentes cuadros clínicos, que pueden ir desde un cuadro agudo/hiperagudo con fiebre, hematuria, hemoglobinuria, meningitis, e incluso mortalidad a un cuadro crónico cuya única signología aparente es la falla reproductiva.
Los bovinos son huéspedes de mantenimiento de L. borgpetersenii serovar Hardjo-bovis, y los animales infectados típicamente no muestran signos aparentes de la infección, excepto durante la gestación. Las fallas reproductivas (abortos, mortinatos, y nacimiento de crías débiles) y la producción reducida de leche debido a la infección por la serovar Hardjo, tienen un significativo impacto sobre la industria de carne y leche. Además, como patógeno humano, la serovar Hardjo es una amenaza para la salud de los trabajadores en la industria animal.
Leptospira borgpetersenii serovar Hardjo-bovis es la causa más común de aborto e infertilidad en bovinos de Norte América. Hardjo es una serovar adaptada a los bovinos, los cuales se convierten en portadores crónicos y actúan como reservorios de la infección. L. interrogans serovars Pomona, Icterohaemorrhagiae, y Grippotyphosa son leptospiras no adaptadas a los bovinos pero los infectan como hospedadores accidentales, causando enfermedad aguda y aborto. Otra bacteria asociada a aborto en bovinos es el serogrupo Hebdomadis, serotipo sejroe. Los perros son portadores de las principales serovares de leptospiras que afectan a los bovinos – Hardjo, Pomona, Grippotyphosa, Icterohaemorrhagiae y Canicola –, ésta última también causa trastornos en bovinos.
Leptospirosis en caninos. La leptospirosis es considerada una enfermedad infecciosa emergente en humanos, y por lo tanto, de gran importancia en salud pública. La leptospirosisse ha extendido en todo el mundo en perros callejeros. Las serovares más frecuentes asociadas con leptospirosis canina son canicola, pomona, grippotyphosa, bratislava e icterohaemorrhagiae, aunque han sido reportadas infecciones con otras serovares con insuficiencia renal aguda, en perros de Norteamérica. Los perros se asocian a la serovar canicola como hospedadores de mantenimiento, mientras que las ratas son reservorios de la serovar icterohaemorrhagiae. La leptospirosis en perros es reconocida como un factor de riesgo para el humano. El aumento de lluvias se asocia con la prevalencia de leptospirosis en perros. Un perro infectado puede ser un portador asintomático de leptospira y arrojar microorganismos a través de la orina por toda su vida. Las lesiones macroscópicas pueden mostrar hepatomegalia, esplenomegalia, e ictericia en mucosas y tejido subcutáneo, y hemorragias petequiales diseminadas en casi todos los órganos y tejidos. Los hallazgos histológicos muestran infiltrados inflamatorios difusos y las leptospiras se encuentran en muchos órganos, incluyendo pulmón, hígado y riñones. En los riñones se detectan áreas de necrosis cortical con marcado edema intersticial, glomerulitis, nefritis intersticial con infiltración de neutrófilos, linfocitos, monocitos, células plasmáticas y ocasionalmente infartos, la nefritis tubulointersticial y necrosis tubular aguda son los hallazgo histológico más comunes, pero se puede desarrollar una fibrosis tubulointersticial.
En perros callejeros de México se han observado alrededor de un 67.5% de sueros positivos por MA, y 21.0% de sospechosos a las serovares Canicola y Portland–vere ambas con un porcentaje de 60.4%, seguidas por Bratislava (39.5%), Cepa Palo Alto (32.5%), Pyrogenes (30.2%), Icterohaemorrhagiae (25.5%), Grippotyphosa (6.9%), Pomona (6.9%), y Cepa Inifap (4.6%).
En Brasil estudios realizados con MA muestran una prevalencia de leptospirosis en todo el país de 26%, siendo los serotipos más prevalentes Autumnalis (34.2%), Tarassovi (23.7%), Canicola (17.1%), Grippotyphosa (14.5%) y otros con prevalencia menor como Bratislava (3.9%), Icterohaemorrhagiae (2.7%), Australis, Pomona y Wolffi con (1.3%) (De Castro y col., 2011). En Buenos Aires, Argentina se encontró una seropositividad en 57% de perros examinados; 82% de los sueros positivos aglutinaron con dos o más serotipos. Los serotipos detectados con mayor frecuencia fueron Canicola y Pyrogenes. En Estados Unidos y Canadá se han documentado estudios que muestran a Leptospira serovar Autumnalis, Grippotyphosa y Pomona como las principales serovariedades en perros. De estas, las serovares encontradas en nuestro país son Canicola, Grippotyphosa, Bratislava, Icterohaemorrhagiae y Pomona, pero además hay otras serovares de aislamientos nacionales no notificadas en estudios en otros países como las cepas Portland-vere, INIFAP y Palo Alto. Los perros son considerados los hospedadores de mantenimiento para la serovar Canicola y hospedador incidental para otras serovares, y son una fuente potencial de infección para los dueños de las mascotas.
Leptospirosis en equinos. La leptospirosis es una enfermedad infecciosa zoonótica de distribución mundial que afecta a humanos, animales domésticos y silvestres, incluyendo a los equinos. La infección resulta frecuentemente por transmisión directa con orina contaminada o líquidos de placentas, o indirectamente por un ambiente contaminado. Las manifestaciones clínicas de leptospirosis varían de aguda, subaguda a infección crónica. La enfermedad severa incluye ictericia, hemoglobinuria, falla renal, meningitis y aborto, en todos los animales domésticos. Las formas subclínicas quizá sean más comunes con animales infectados crónicamente, los cuales pueden ser portadores por toda su vida.
Los principales trastornos reportados en equinos son la uveítis, aborto, potrillos nacidos débiles, potrillos prematuros, disfunción renal y disfunción hepática. Los signos observados incluyen hematuria, fiebre, ictericia, anorexia y trastornos respiratorios.
La evidencia serológica de infecciones por Leptospira en equinos se debe predominante mente a la serovares de L. interrogans sv Pomona, L. interrogans sv Bratislava, L. interrogans sv Icterohaemorrhagiae y L. kirschneri sv Grippotyphosa.
En equinos de México se han reportado frecuencias de serovariedades en tres centros ecuestres que incluyen L. pyrogenes (100%), L. canicola (96%), L. jez bratislava (56.5%, 61.1% y 80.6%), L. pryrogenes (61.1% y 72.2%), L. autunmalis (66.7%).
Diagnóstico. La mayoría de los casos de leptospirosis son diagnosticados por serología para detectar anticuerpos, debido a que el cultivo de leptospiras a partir de líquidos biológicos (sangre, líquido cefalorraquídeo, orina, leche) toma varias semanas, además de ser costoso. La prueba de aglutinación microscópica (AM), conocida como la prueba de oro, es la técnica de referencia más utilizada, a pesar de que se ha encontrado que la tasa de resultados falsos negativos es de 13%. La AM Está basada en la evaluación de muestras de sueros pareados y tiene la habilidad de aglutinar cepas de serovares de referencia con una batería de antígenos vivos de Leptospira.
La prueba de AM es altamente específica, pero su baja sensibilidad (30-60%) la hace inadecuada para el diagnóstico de leptospirosis aguda. Otras pruebas serológicas como hemaglutinación indirecta, aglutinación en microcápsula y aglutinación en látex, y ELISA, no ofrecen niveles satisfactorios de sensibilidad y especificidad para el diagnóstico en fase temprana de leptospirosis, en la detección de anticuerpos IgM. La prueba de la reacción en cadena de la polimerasa es precoz y sensible, pero su alto costo y la necesidad de tener un buen control de calidad son los mayores inconvenientes para su aplicación.
El antígeno de Leptospira interrogans Hardjo-prajitno es muy sensible para la detección de anticuerpos de Hardjo en la prueba de AM, ya que detecta el 98.4% de los sueros positivos a Hardjo-prajitno, comparado con el 1.6% que detecta el antígeno de Leptospira borgpetersenii Hardjo-bovis.
Hay varios problemas potenciales asociados con el mantenimiento de las cepas de referencia de Leptospira; La contaminación de cepas con otras bacterias o leptospiras saprofitas de rápido crecimiento, el etiquetado incorrecto o el cambio de cepas. La contaminación por otras bacterias se reconoce fácilmente pero el cambio de cepas es un grave error. Además, si no hay un adecuado control de calidad que se lleve a cabo sobre las cepas de referencia, estos problemas no pueden ser identificados de manera oportuna. Esto podría afectar adversamente la investigación de brotes y estudios epidemiológicos.
Profilaxis y tratamientos. La inmunidad a las leptospiras es serogrupo específica, y el conocimiento de los serogrupos, que comúnmente causan enfermedad en una región geográfica particular, es importante para el desarrollo de vacunas.
Algunas vacunas comerciales monovalentes serovar Hardjo inducen proliferación de células T CD4+ y producción de interferón gamma (IFN-γ) en respuesta a un antígeno de la serovar. La inducción de esta respuesta parece proporcionar a corto plazo (4 meses) la inmunidad protectora contra la eliminación urinaria o una infección renal después de la exposición en vivo. Estas vacunas reducen la colonización renal y la eliminación urinaria de bacterias, sin embargo, ninguna vacuna proporciona inmunidad estéril ya que es posible detectar antígeno en la mayoría de los animales vacunados con técnicas de PCR.
Los tratamientos que en la actualidad actúan sobre las leptospiras son doxyciclina, amoxicilina, ampicilina, eritromicina, azytromicina, fluoroquinolona, cefalosporinas.



